Energia de ionização
define-se como energia de ionização ou também chamada de potencial de ionização, a energia a ser fornecida a um átomo neutro, gasoso e em estado fundamental para extrair um eletrón em sua camada mais fraca.
A Energia e a Ionização do Átomo
Outra definição: A facilidade com que você pode remover um elétron de um átomo é medida por sua energia de ionização, que é definida como a energia mínima necessária para remover um elétron do átomo na fase gasosa:
Podemos expressar assim:
X + 1E.I. -----> X (positivo) + 1E-
E.I = energia de ionização
Sendo esta correspondente a primeira energia da primeira ionização. A segunda energia de ionização é a energia necessária para remover um segundo elétron e seu valor é sempre maior do que a primeira, porque o volume de um íon positivo é menor que a do átomo neutro e a força eletrostática é maior no íon positivo do que no átomo, uma vez que mantém a mesma carga nuclear:
X (positivo) + 2 E.I.-----> X 2+ + e -
Lembre-se: a segunda energia de ionização de um elemento (energia necessária para remover um elétron ao cátion + A) é maior do que o primeiro, enquanto a terceira energia de ionização é ainda maior.
Você pode deduzir o significado da energia de ionização do terceiro eletrón e os outros posteriores.
A energia de ionização é expressa em elétron-volts, joules ou quilojoules por mol.
1 eV = 1,6.10 -19 Coulombs. 1 volt = 1,6.10-19 joule
Os elementos da mesma família ou grupo de energia de ionização diminui com o aumento do número atômico, ou seja, para cima e para baixo.
Nos elementos de mesmo período, a energia de ionização cresce a medida que o número atômico aumenta, ou seja, da esquerda para a direita.
A energia de ionização é maior nos gases nobres, já que a sua configuração eletrônica é a mais estável e, portanto, terá que fornecer mais energia para remover um elétron. Pode-se deduzir quais são os elementos que têm os maiores valores para a segunda e terceira energia de ionização. Observe que esta não se refere à energia necessária para remover um elétron de camadas internas, lembre-se que eles são mais agarrados ao átomo, porque eles estão mais próximos.
Para retirar os elétrons restantes é necessária cada vez mais energia (ou seja, a energia de ionização é maior para cada elétron subseqüente).
Descendo uma família, a distância entre o núcleo e o elétron aumenta e a atração entre o elétron e o núcleo diminui.
Quando retiramos muitos elétrons, o núcleo se torna mais positivo, a carga nuclear efetiva aumenta sua atração sobre os elétrons e torna-se mais difícil remover um elétron mais próximo de núcleo do átomo.
Elétrons e Orbitais de Valência:
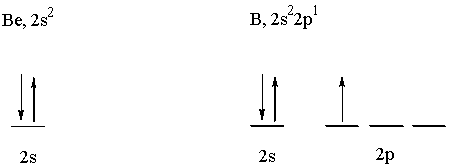
Tabela de Ionização:

Professor, empregos e vagas em todo o país.
Nenhum comentário:
Postar um comentário